SECRETARÍA DE REGULACIÓN Y GESTIÓN SANITARIA Y SECRETARÍA DE ALIMENTOS Y BIOECONOMÍA
Resolución Conjunta 12/2018
RESFC-2018-12-APN-SRYGS#MSYDS
Ciudad de Buenos Aires, 31/10/2018
VISTO el expediente N° 1-0047-2110-003246-14-2 de la ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS ALIMENTOS Y TECNOLOGÍA MÉDICA, y
CONSIDERANDO:
Que los preparados para lactantes son sucedáneos de la leche materna especialmente fabricados para satisfacer las necesidades nutricionales de los lactantes cuando no es posible la lactancia materna o ésta es parcial.
Que el Código Internacional de Comercialización de Sucedáneos de la Leche Materna de la Organización Mundial de la Salud se encuentra incluido en el Código Alimentario Argentino (CAA) y se ha aceptado en todos sus términos según Resolución N° 54/97 MSyAS.
Que en el marco de la Ley 26.873 Lactancia Materna Promoción y Concientización Pública y su Decreto Reglamentario Nº 22/2015, el alcance de los sucedáneos de la leche materna se establece dentro de los límites de edad de 0 a 24 meses.
Que dichos preparados constituyen la fuente de alimentación hasta la introducción de una alimentación complementaria apropiada y el principal elemento líquido de la dieta progresivamente diversificada.
Que actualmente los alimentos para lactantes se encuentran contemplados en el Capítulo XVII del CAA.
Que el artículo 1353 del CAA en el inciso a) cita a los preparados líquidos o en polvo que por su composición puedan sustituir parcial o totalmente la alimentación específica de los lactantes sin establecer requisitos particulares de composición y rotulado.
Que actualmente los preparados para lactantes se comercializan en el mercado como fórmulas para lactantes de inicio (destinadas a satisfacer las necesidades nutricionales de los lactantes durante los primeros meses de vida hasta la introducción de la alimentación complementaria apropiada) y de continuación (destinadas a satisfacer parcialmente las necesidades nutricionales de los lactantes desde la introducción de la alimentación complementaria hasta los 12 meses de vida cuando no es posible la lactancia materna o cuando ésta es parcial).
Que se elaboró una propuesta de normativa basada fundamentalmente en las recomendaciones del Codex Alimentarius “Preparados para Lactantes y Preparados para Usos Medicinales Especiales Destinados a los Lactantes”, CODEX STAN 72 – 1981 y en las regulaciones de la Unión Europea (UE), Brasil, Canadá, Chile, Australia y Nueva Zelanda y los antecedentes del Codex Alimentarius, la Organización de las Naciones Unidas para la Agricultura y la Alimentación/Organización Mundial de la Salud (FAO/OMS) y la Agencia Española de Seguridad Alimentaria y Nutrición (AESAN).
Que el Reglamento Delegado UE 127/2015 establece los requisitos específicos de composición e información aplicables a los preparados para lactantes y preparados de continuación, así como los requisitos de información sobre los alimentos destinados a los lactantes y niños de corta edad.
Que en consecuencia, es necesario establecer dos categorías de fórmulas para lactantes: de inicio y de continuación.
Que con respecto a la información contenida en los rótulos es preciso establecer requisitos específicos de rotulado acorde a lo establecido en Código Internacional de Comercialización de Sucedáneos de la Leche Materna, sus resoluciones posteriores, la Ley Nº 26.873 y su Decreto Reglamentario Nº 22/2015.
Que la Ley 26.873 Lactancia Materna Promoción y Concientización Pública y su Decreto Reglamentario Nº 22/2015 establece en su artículo 4º inciso n) “Difundir el Código Internacional de Sucedáneos de la Leche Materna, conforme lo establecido por el Código Alimentario Argentino, ley 18.284 y sus normas complementarias”; entendiéndose a los efectos de la difusión del mencionado Código que su alcance en los términos de la mencionada Ley es hasta los DOS (2) primeros años de edad del niño.
Que, en consecuencia, resulta necesaria la incorporación al CAA del artículo 1353 bis relativo a requisitos específicos de composición, definición y rotulado de las fórmulas para lactantes.
Que en el proyecto de resolución tomó intervención el Consejo Asesor de la COMISIÓN NACIONAL DE ALIMENTOS (CONAL) y que dicho proyecto fue sometido a consulta pública.
Que la CONAL ha evaluado los antecedentes y se ha expedido favorablemente.
Que los Servicios Jurídicos Permanentes de los Organismos involucrados han tomado intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por los Decretos 815/99 y 174/18, sus normas complementarias y modificatorias, y 802/18.
Por ello,
LA SECRETARIA DE REGULACIÓN Y GESTIÓN SANITARIA
Y
EL SECRETARIO DE ALIMENTOS Y BIOECONOMÍA
RESUELVEN:
ARTÍCULO 1º.- Incorpórase al Código Alimentario Argentino el Artículo 1353 bis el cual quedará redactado de la siguiente forma: “Artículo 1353 bis: Con la denominación de fórmula para lactantes se entiende a los productos destinados a utilizarse, cuando sea necesario, como sucedáneo de la leche materna para satisfacer las necesidades nutricionales de los lactantes.
Deberán presentarse en forma líquida o en polvo y estar elaboradas a base de leche y/o de otros ingredientes idóneos para la alimentación de los lactantes. La leche podrá ser sustituida por derivados de vegetales cuyas proteínas respondan a los requisitos establecidos en el presente artículo.
Deberán ser elaboradas y envasadas de acuerdo a las buenas prácticas de manufactura y contenidas en envases que garanticen la calidad y estabilidad de los productos.
Las empresas que elaboren fórmulas para lactantes deberán implementar un Sistema de Análisis de Peligros y Puntos Críticos de Control (HACCP) de acuerdo a lo establecido en el artículo 1346 bis del presente Código.
Se clasificarán en:
De inicio: son las fórmulas para lactantes destinadas a satisfacer las necesidades nutricionales de los lactantes durante los primeros meses de vida hasta la introducción de la alimentación complementaria apropiada. Estos preparados se utilizarán mediante indicación médica cuando la lactancia materna total no sea posible o cuando sea parcial.
De continuación: son las fórmulas destinadas a satisfacer parcialmente las necesidades nutricionales de los lactantes desde la introducción de la alimentación complementaria hasta los 12 meses de vida cuando no es posible la lactancia materna o cuando ésta sea parcial. Constituyen el principal elemento líquido de la dieta progresivamente diversificada.
Estos productos listos para el consumo, comercializados como tales o preparados de acuerdo con las instrucciones del fabricante, deberán responder a las siguientes exigencias:
A. Deberán contener no menos de 60 kcal (250 kJ) y no más de 70 kcal (293 kJ) de energía por cada 100 ml.
B. Tendrán como mínimo 1,8 y como máximo 3,0 gramos de proteína/100 kcal o como mínimo 0,45 y como máximo 0,7 gramos de proteína/100 kJ.
El cálculo del contenido de proteínas del producto deberá basarse en N x 6,25, salvo que se proporcione una justificación científica para el uso de un factor de conversión diferente aplicable a un determinado producto. Los niveles establecidos para las proteínas se basan en el factor de conversión de nitrógeno de 6,25. El valor de 6,38 se considera el factor específico apropiado para la conversión del nitrógeno en proteínas de leche, mientras que el valor de 5,71 se considera el factor específico para la conversión del nitrógeno en proteínas en productos derivados de la soja.
El valor mínimo de proteína establecido es aplicable a las fórmulas a base de proteína de leche de vaca. Para fórmulas para lactantes basadas en proteína aislada de soja, el valor mínimo de proteína será de 2,25 g/100 kcal (0,5 g/100 kJ).
El perfil de aminoácidos de las proteínas deberá responder cualitativa y cuantitativamente a la proteína de referencia (leche materna) según los valores de aminoácidos esenciales y semiesenciales de la leche materna consignados en la tabla siguiente: “Aminoácidos esenciales y semiesenciales presentes en la leche materna”.
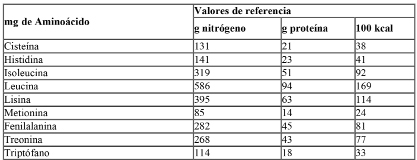

Ref.: Codex Stan 72/1981 enmendado en 1983/85/87/2011/15 y 2016 Revisado 2007 Norma preparados para lactantes y preparados para usos médicos especiales.
Para un valor energético equivalente, estos productos deberán contener una cantidad de cada uno de los aminoácidos esenciales y semiesenciales no menor a la contenida en la proteína de referencia, según la tabla anterior.
A efectos del cálculo:
-Las concentraciones de tirosina y fenilalanina pueden sumarse.
-Las concentraciones de metionina y cisteína pueden sumarse si la proporción es inferior a 2:1; si la proporción está comprendida entre 2:1 y 3:1, la idoneidad del preparado deberá ser demostrada.
Podrán añadirse a las fórmulas aminoácidos esenciales y semiesenciales aislados únicamente para mejorar su valor nutritivo. Sólo podrán utilizarse las formas L de los aminoácidos.
Las fórmulas elaboradas a base de proteína de leche no hidrolizada que contengan menos de 1,8 gramos de proteína/100 kcal y las elaboradas a base de proteína hidrolizada que contengan menos de 2,25 gramos de proteína/100 kcal deberán ser evaluadas por la Autoridad Sanitaria Nacional.
C) El contenido de grasas será como mínimo de 4,4 y como máximo 6,0 gramos de grasas/100 kcal o como mínimo 1,05 y como máximo 1,4 gramos de grasas/100 kJ.
La composición de las grasas deberá responder a las siguientes especificaciones:
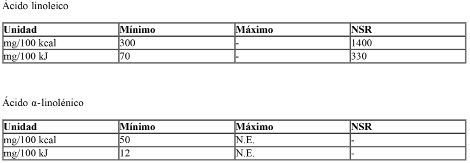
NE: no especificado.
NSR: niveles superiores de referencia. La finalidad de los NSR es proporcionar orientación a los fabricantes; no deben interpretarse como valores deseables.
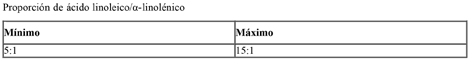
La suma de los ácidos láurico y mirístico, constituyentes naturales de las grasas, no deberá superar el 20% del contenido total de ácidos grasos.
El contenido de ácido erúcico no deberá superar el 1% del contenido total de ácidos grasos.
Los fosfolípidos no deberán superar los 300 mg/100kcal (72 mg/100 kJ).
En las fórmulas no se permite utilizar aceites y grasas parcialmente o totalmente hidrogenadas de origen industrial.
D) El contenido de carbohidratos de las fórmulas será como mínimo 9,0 y como máximo 14,0 gramos/100 kcal o como mínimo 2,2 y como máximo 3,3 gramos/100 kJ.
Solo podrán utilizarse los siguientes hidratos de carbono: lactosa, maltosa, sacarosa, glucosa, maltodextrina, jarabe de glucosa o jarabe de glucosa deshidratado, almidón precocido y almidón gelatinizado. En caso de añadirse almidones precocidos y/o gelatinizados, estos no deberán superar el 30% del total de los hidratos de carbono ni los 2 g/100 ml en el producto listo para el consumo.
Solo se podrá añadir sacarosa a las fórmulas fabricadas a partir de hidrolizados de proteínas. En este caso, su contenido no excederá el 20% del contenido total de hidratos de carbono.
Solo podrá añadirse glucosa a las fórmulas fabricadas a partir de hidrolizados de proteínas. En este caso, su contenido no excederá los 2 g/100 kcal (0,5 g/100 kJ).
El valor mínimo para la lactosa será de 4,5 g/100 kcal o 1,1 g/100 kJ. Este valor no es aplicable a los preparados en los que los aislados de proteínas de soja supongan más del 50% del total del contenido en proteínas.
Podrán elaborarse fórmulas sin lactosa, las que deberán tener un contenido de lactosa inferior a 10 mg/100 kcal (2,5 mg/100 kJ).
E) Vitaminas, Minerales y otros Nutrientes:
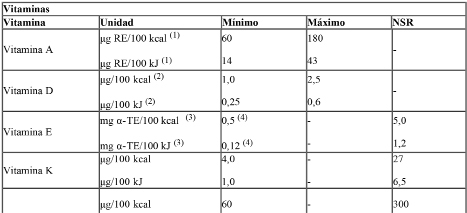
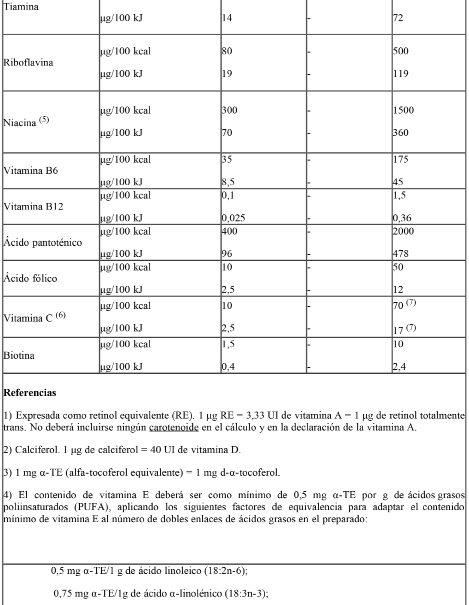
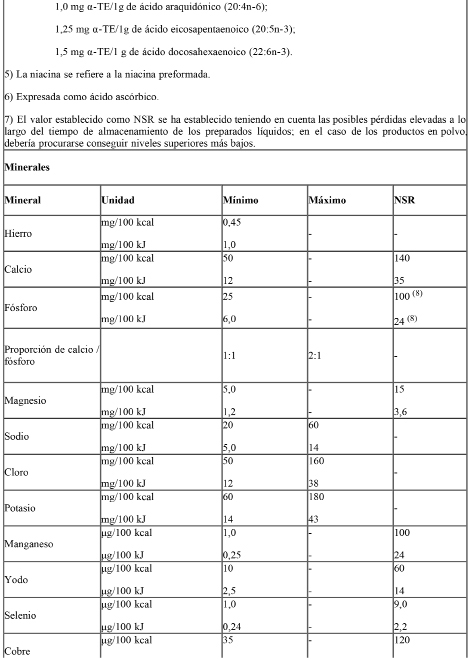

Ref.: CAC/GL 10 – 1979. Listas de referencia de compuestos de nutrientes para su utilización en alimentos para fines dietéticos especiales destinados a los lactantes y niños pequeños.
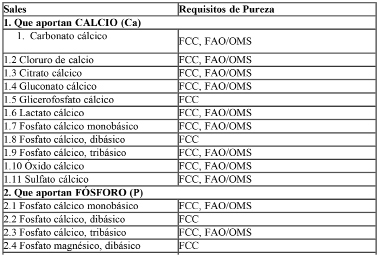
Las sales minerales y compuestos vitamínicos adicionados a las fórmulas deberán ser los especificados en la Tabla I: “Sales minerales y compuestos vitamínicos de referencia para éstas fórmulas”.
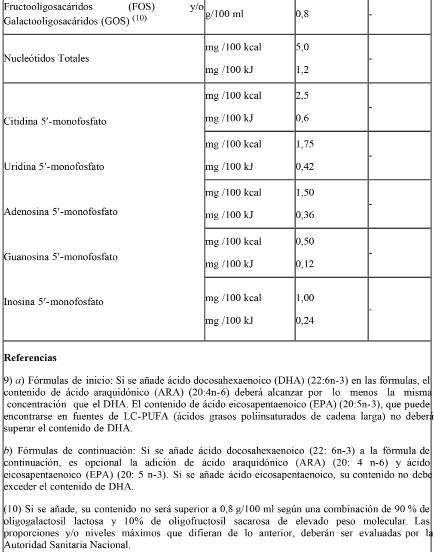
Las fórmulas de inicio deberán contener además los nutrientes establecidos en el siguiente cuadro según los límites consignados:
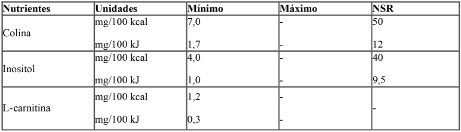
Las fórmulas de continuación podrán contener los nutrientes antes mencionados según los límites consignados.
Además de los nutrientes especificados anteriormente, las fórmulas de inicio y de continuación podrán contener los siguientes ingredientes opcionales según los límites establecidos:
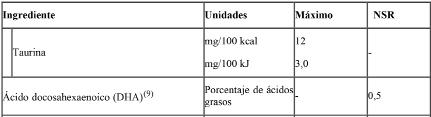
Podrán emplearse únicamente cultivos que produzcan ácido láctico L (+).
En el caso de ingredientes o proporciones de ingredientes no contemplados en el presente artículo y que se encuentran en la leche materna, o ingredientes para proporcionar beneficios análogos a ésta, será la Autoridad Sanitaria Nacional la encargada de evaluar su idoneidad e inocuidad en base a la evidencia científica. Deberán estar científicamente demostradas tanto la inocuidad como la idoneidad nutricional para favorecer el crecimiento y el desarrollo de los lactantes.
Las fórmulas deberán cumplir además con los siguientes requisitos:
a) No contener gluten.
b) No contener fluoruro agregado. Su nivel no deberá superar los 100 µg/100 kcal (24 µg/100 kJ) en el producto listo para el consumo.
c) El contenido de plomo no podrá superar 0,01 mg/kg del producto listo para el consumo.
d) El contenido de arsénico no podrá superar los 0,05 mg/kg del producto listo para el consumo.
e) El contenido de aluminio no podrá superar 1 mg/kg del producto listo para el consumo.
f) Deberán estar exentas de grumos o partículas gruesas y ser aptas para suministrarse a los lactantes.
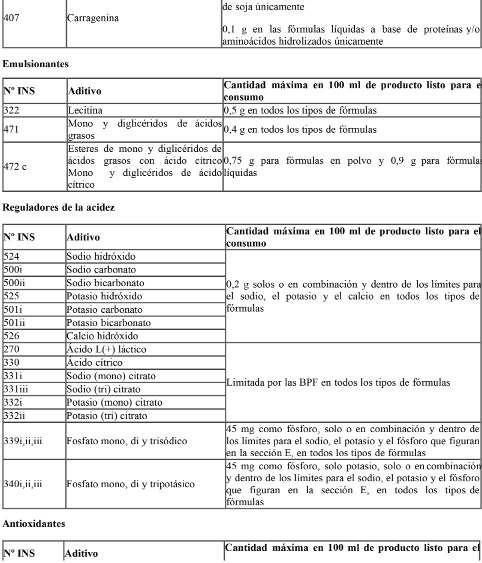
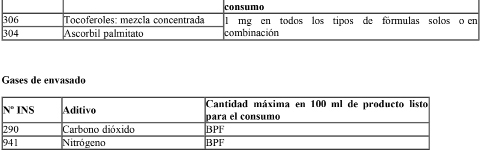
Las fórmulas podrán contener únicamente los aditivos alimentarios en las concentraciones indicadas en el siguiente cuadro:
Espesantes

Estos productos se denominarán “Fórmula para lactantes en polvo/líquida (según corresponda) “. Se deberá indicar por debajo de la denominación el o los ingredientes opcionales distintivos (en el caso de corresponder) y, en las proximidades, la leyenda “de inicio” o “de continuación” según corresponda.
Cuando las fórmulas estén elaboradas totalmente a partir de las proteínas procedentes de la leche, se denominarán “Fórmula láctea para lactantes en polvo/líquida (según corresponda) “. Se deberá indicar por debajo de la denominación el o los ingredientes opcionales distintivos (en el caso de corresponder) y, en las proximidades, la leyenda “de inicio” o “de continuación” según corresponda.
Cuando las fórmulas estén elaboradas totalmente a partir de proteínas vegetales, se denominarán “Fórmula para lactantes a base de (…) en polvo/líquida (según corresponda) “, especificando el origen de las proteínas. Se deberá indicar por debajo de la denominación el o los ingredientes opcionales distintivos (en el caso de corresponder) y, en las proximidades, la leyenda “de inicio” o “de continuación” según corresponda.
Deberán cumplir con los requisitos generales de rotulado establecidos en el presente Código y con los siguientes requisitos específicos para la información nutricional:
- Se deberán declarar: valor energético (expresado en kJ y kcal), carbohidratos (enumerando cada mono y disacárido), proteínas, grasas totales, grasas saturadas, grasas trans, grasas mono y poliinsaturadas (indicando cada ácido graso mono y poliinsaturados) y colesterol, fibra alimentaria, sodio, vitaminas, minerales, y cualquier otro nutriente (expresados únicamente en g, mg o µg según corresponda) por 100 g o 100 ml del producto tal como se ofrece al consumidor y por cada 100 kcal tal como se ofrece al consumidor.
- Adicionalmente, se podrá expresar la información nutricional por 100 ml del producto listo para el consumo de acuerdo a las indicaciones de preparación del fabricante.
En el rótulo de las fórmulas deberá incluirse la siguiente información:
- Gráficas que ilustren el modo de preparación.
- La leyenda “AVISO IMPORTANTE”, con letras de altura no menor de 4 mm y buen contraste, realce y visibilidad, seguida de una afirmación que manifieste la superioridad de la lactancia materna.
- Las frases obligatorias: “Consulte a su Médico” y “Por consultas sobre lactancia puede comunicarse al 0800-222-1002 desde cualquier lugar del país.”
- Para las fórmulas de inicio: “La leche materna es el mejor alimento para tu bebé. Hasta los seis meses de vida no necesita ningún otro alimento o bebida.”
- Para las fórmulas de continuación: “La leche materna sigue siendo la mejor leche para tu bebé hasta por lo menos los dos años de vida” y una mención de que el producto solo es adecuado para lactantes mayores de 6 meses y como parte de una dieta diversificada, y que no debe utilizarse durante los primeros 6 meses de vida.
- Instrucciones para el uso apropiado del producto, así como para su conservación y la eliminación del preparado sobrante.
- Una advertencia acerca de los riesgos que pueden derivarse de un almacenamiento, una preparación o un uso inadecuados.
- Para las fórmulas en polvo, además: “Reconstituir con agua potable”.
- Información que indique que los preparados en polvo no son estériles.
- La indicación del origen y la naturaleza de las proteínas y de los hidrolizados proteicos.
Cuando corresponda, podrá indicarse por debajo de la denominación una mención que indique la característica nutricional específica para la cual fue diseñado el producto: sin lactosa, con proteínas hidrolizadas o formuladas con el fin de evitar la regurgitación. Para aquellas fórmulas “Sin lactosa” que contuvieren galactosa, deberá indicarse el contenido de galactosa en la información nutricional.
Toda la información contenida en los rótulos y publicidad deberá cumplir con lo establecido en el Código Internacional de Comercialización de Sucedáneos de la Leche Materna y sus resoluciones posteriores; como también con lo establecido en la Ley Nacional Nº 26.873 y su reglamentación (Decreto Nº 22/2015), entendiéndose que la aplicación de todos los términos del Código Internacional de Comercialización de Sucedáneos de la Leche Materna se extiende hasta los dos años de vida del niño. Además no deberán incluirse en el rotulado y publicidad (incluidas las marcas) declaraciones de propiedades nutricionales y/o menciones que declaren, sugieran o impliquen que existe una relación entre la fórmula o un ingrediente de la fórmula y la salud del lactante.
Tabla I: Lista de Referencia de Sales Minerales y Compuestos Vitamínicos para uso en las fórmulas.
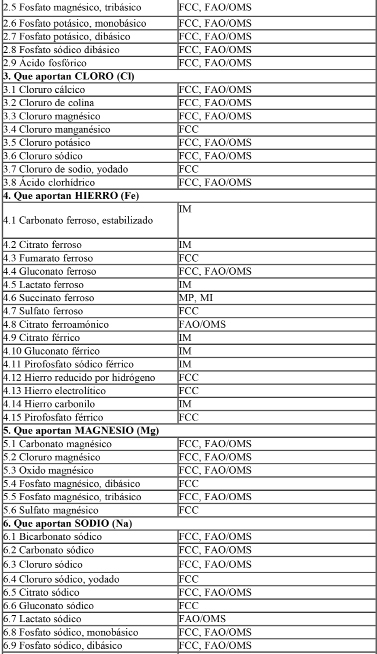
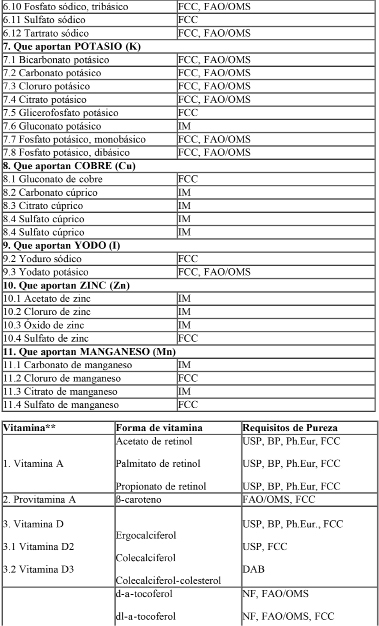
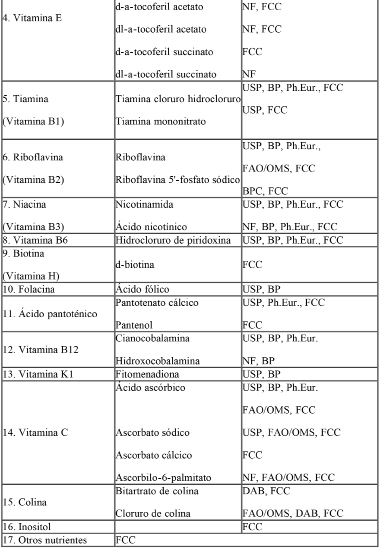
Abreviaturas:
USP = United States Pharmacopoeia
NF = United States National Formulary
BP = British Pharmacopoeia, incluído addenda
BPC = British Pharmaceutical Codex
Ph.Eur. = European Pharmacopoeia
FAO/OMS = Principios Generales para el Uso de Aditivos Alimentarios, V1 Codex Alimentarius.
DAB = Deutsches Arzneibuch 7
FCC = Food Chemicals Codex
IM = Index Merck
Para los nutrientes no contemplados
**Podrán emplearse como vehículo los aditivos contemplados en el presente artículo y las siguientes sustancias comestibles cuando por razones tecnológicas se requieran.
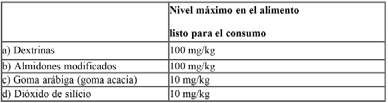
CAC/GL 10 - 1979 Listas de Referencia de Compuestos de Nutrientes para su utilización en Alimentos para Fines Dietéticos Especiales destinados a los Lactantes y Niños Pequeños.
ARTÍCULO 2°.- La presente Resolución entrará en vigencia a partir del día siguiente al de su publicación en el Boletín Oficial.
ARTÍCULO 3°.- Otórgase a las empresas un plazo de TRESCIENTOS SESENTA Y CINCO (365) días a partir de la entrada en vigencia de la presente Resolución para su adecuación.
ARTÍCULO 4°.- Regístrese, comuníquese a quienes corresponda. Dese a la DIRECCIÓN NACIONAL DEL REGISTRO OFICIAL para su publicación. Cumplido, archívese. Josefa Rodriguez Rodriguez - William Andrew Murchison
e. 21/11/2018 N° 88493/18 v. 21/11/2018
Fecha de publicación 21/11/2018





