SECRETARÍA DE REGULACIÓN Y GESTIÓN SANITARIA Y SECRETARÍA DE ALIMENTOS Y BIOECONOMÍA
Resolución Conjunta 21/2019
RESFC-2019-21-APN-SRYGS#MSYDS
Ciudad de Buenos Aires, 27/05/2019
VISTO el Expediente N° EX-2018-33493760--APN-DERA#ANMAT de la ADMINISTRACIÓN NACIONAL DE MEDICAMENTOS ALIMENTOS Y TECNOLOGÍA MÉDICA; y
CONSIDERANDO:
Que en la órbita del SERVICIO NACIONAL DE SANIDAD Y CALIDAD AGROALIMENTARIA (SENASA), organismo descentralizado dependiente de la SECRETARÍA DE GOBIERNO DE AGROINDUSTRIA del MINISTERIO DE PRODUCCIÓN Y TRABAJO, a través de la Resolución SENASA Nº 563 – E/2017, incorporó al producto “colágeno hidrolizado” al Numeral 19.16 del Capítulo XIX del Reglamento de Inspección de Productos, Subproductos y Derivados de Origen Animal aprobado por el Decreto N° 4.238 del 19 de julio de 1968.
Que la Cámara Argentina de la Industria de Chacinados y Afines realizó una presentación en la que se solicita la incorporación del colágeno para su utilización en chacinados.
Que la COMISIÓN NACIONAL DE ALIMENTOS consideró oportuna la incorporación en el Capítulo VI del Código Alimentario Argentino referido a Alimentos Cárneos y Afines en su Artículo 323, así como sus especificaciones en el Capítulo de Misceláneos.
Que los límites de metales establecidos en las especificaciones para dicho producto fueron tomados del Reglamento (CE) Nº 853/2004 del Parlamento Europeo y del Consejo del 29 de abril de 2004 por el que se establecen normas específicas de higiene de los alimentos de origen animal.
Que en el proyecto de Resolución Conjunta tomó intervención el Consejo Asesor de la Comisión Nacional de Alimentos (CONASE) y se sometió a la Consulta Pública.
Que la COMISIÓN NACIONAL DE ALIMENTOS ha intervenido, expidiéndose favorablemente.
Que los Servicios Jurídicos Permanentes de llos organismos correspondientes han tomado la intervención de su competencia.
Que se actúa en virtud de las facultades conferidas por los Decretos Nº 815/99 y Nº 174/18, sus normas complementarias y modificatorias.
Por ello,
LA SECRETARIA DE REGULACIÓN Y GESTIÓN SANITARIA
Y
EL SECRETARIO DE ALIMENTOS Y BIOECONOMÍA
RESUELVEN:
ARTÍCULO 1º.-Sustitúyese el Artículo 323 del CAA el que quedará redactado de la siguiente manera: “Artículo 323: Se permite la adición a los chacinados de substancias amiláceas alimenticias, como ligantes, en las siguientes proporciones en peso, referidos al producto terminado.
Chacinados frescos, máx 5%
Chacinados secos, máx 3%
Chacinados cocidos, máx 10%
Se admite también el agregado a los chacinados, como ligantes o extensores, de aislados proteínicos de soja, texturizados o no, hasta un máximo de 2% en peso referido al producto terminado.
Se permite el agregado de texturizado de soja como extensor, hasta un máximo de 10% en base seca en el producto terminado, debiendo declararse este agregado en la denominación del producto (por ej.: salchichas con soja, hamburguesas con soja) con caracteres de igual tamaño y su porcentaje en la lista de ingredientes, con caracteres de buen tamaño realce y visibilidad.
Se permite el agregado de carne de cerdo en polvo con contenido proteico entre 60% y 90% para su uso en productos cárnicos a base de cerdo crudos y cocidos en dosis máximas del 3%; debiendo consignarse en la lista de ingredientes como “carne de cerdo en polvo”.
Se permite el agregado de colágeno en una dosis máxima del 1% a chacinados frescos, secos y cocidos que cumplan con la definición y especificaciones establecidas en el numeral 13 del Artículo 1.417 del presente Código. Quedan exceptuadas de esta autorización las salazones.”
ARTÍCULO 2º.- Sustitúyese el Artículo 1417 del CAA, el que quedará redactado de la siguiente manera: “Artículo 1.417: Los ingredientes/productos que a continuación se listan deberán responder a las características que se establecen en cada caso:
1. CLORURO DE POTASIO
Identificación y pureza según lo establecido en JECFA, FCC y/o UE.
Usos: como ingrediente para utilizarlo en reemplazo parcial o total del cloruro de sodio (NaCl) en todas las categorías de alimentos en cuya definición se establezca un límite máximo de contenido de sodio o como aditivo en los casos en que la normativa vigente así lo permita.
2. ISOMALTO OLIGOSACÁRIDOS
Con la denominación de Jarabe de isomalto-oligosacáridos o IMO jarabe, se entiende el producto obtenido mediante hidrólisis enzimática controlada del almidón de maíz, y que consiste principalmente de oligómeros de isomaltosa, panosa, isomaltotriosa, e isomaltotetraosa conectados por uniones alfa 1-6 glicosídicas no digeribles.
Características: Líquido claro, viscoso y ligeramente dulce.
Extracto seco, mín.: 78% p/p
Azúcares (mono y disacáridos): máx. 46% p/p (sobre sustancia seca) Oligosacáridos de 3 a 6 unidades: mín. 30% p/p (sobre sustancia seca) Oligosacáridos de más de 7 unidades: mín. 20% p/p (sobre sustancia seca) Cenizas (sobre sustancia seca), máx.: 0,2% p/p
Dióxido de azufre total, máx.: 40 mg/kg
Arsénico como As, máx.: 1 mg/kg
Cobre como Cu, máx.: 5 mg/kg
Plomo como Pb, máx.: 2 mg/kg
Este producto se rotulará: “Jarabe de isomalto-oligosacáridos”.
Con la denominación de jarabe de isomalto-oligosacáridos deshidratado o jarabe de IMO deshidratado, se entiende el producto obtenido mediante hidrólisis enzimática controlada del almidón de maíz, y que consiste principalmente de oligómeros de isomaltosa, panosa, isomaltotriosa, e isomaltotetraosa conectados por uniones alfa 1-6 glicosídicas no digeribles, del que se ha separado la casi totalidad del agua.
Características: Polvo blanco, higroscópico, soluble en agua.
Humedad, máx.: 5% p/p
Azúcares (mono y disacáridos): máx. 46% p/p (sobre sustancia seca) Oligosacáridos de 3 a 6 unidades: mín. 30% p/p (sobre sustancia seca) Oligosacáridos de más de 7 unidades: mín. 20% p/p (sobre sustancia seca) Cenizas (sobre sustancia seca), máx.: 0,2% p/p
Dióxido de azufre total máx.: 40 mg/kg
Arsénico como As, máx.: 1 mg/kg Cobre como Cu, máx.: 5 mg/kg
Plomo como Pb, máx.: 2 mg/kg
Este producto se rotulará: “Jarabe de isomalto-oligosacáridos deshidratado o jarabe de IMO deshidratado”.
3. TREHALOSA
Sinónimos: alfa, alfa -trehalosa
Definición: Disacárido no reductor consistente en dos moléculas de glucosa unidas por un puente alfa -1,1-glucosídico. Se obtiene del almidón mediante un proceso enzimático en varios pasos.
Se presenta como dihidrato.
Nombre químico: alfa -D-glucopiranosila -D-glucopiranósido, dihidrato
Número CAS: 6138-23-4 (dihidrato)
Fórmula química: C12 H22 O11 · 2H2O (dihidrato)
Peso molecular: 378,33 (dihidrato)
Descripción: Casi inodoro, cristales blancos o casi blancos de sabor dulce. Características
Solubilidad: Soluble en agua, apenas soluble en etanol.
Rotación específica: [alfa] D20 + 199° (solución acuosa al 5%).
Punto de fusión: 97°C (dihidrato)
Pureza: No menos del 98% de materia seca. Pérdida por desecación: No Más del 1,5% (60° C, 5 h).
Cenizas totales: No más del 0,05%.
Plomo: No más de 1 mg/kg.
Método de determinación: Contenido en el Anexo de la Decisión de la Comisión de las Comunidades Europeas Nº 721, de fecha 25 de septiembre de 2001. Uso: en productos en los que se sustituyen los ingredientes tipificados en el presente código.
Leyendas:
“La trehalosa en una fuente de glucosa”
“El consumo de más de 50 g de trehalosa produce efecto laxante. Una porción de este producto contiene... g de trehalosa”.
4. ISOMALTULOSA
Con la denominación de Isomaltulosa, se entiende el producto obtenido mediante isomerización enzimática de la sacarosa, y que consiste principalmente de glucosa y fructosa unidas por un enlace glucosídico alfa 1-6. Características: sustancia blanca o incolora, cristalina, dulce, leve olor específico de isomaltulosa.
Isomaltulosa: no menos de 98% p/p (sobre sustancia seca).
Agua: máx. 6% p/p.
Otros sacáridos: máx. 2% p/p (sobre sustancia seca).
Cenizas: máx. 0,01% p/p (sobre sustancia seca).
Plomo como Pb: máx. 0,1 mg/kg (sobre sustancia seca).
Metodología de análisis: FCC
Este producto se rotulará: “Isomaltulosa”.
5. L - CARNITINA
Identificación y pureza según lo establecido en FCC.
Uso: como ingrediente para utilizar en suplementos dietarios, fórmulas infantiles y alimentos para propósitos médicos.
6. CARNITINA (Clorhidrato)
Identificación y pureza según lo establecido en FCC.
Uso: como ingrediente para utilizar en suplementos dietarios, fórmulas infantiles y alimentos para propósitos médicos.
7. HIERRO ELECTROLÍTICO
Identificación y pureza según lo establecido en FCC, USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en suplementos dietarios y alimentos fortificados.
8. HIERRO (II) FUMARATO
Identificación y pureza según lo establecido en FCC, USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en suplementos dietarios y alimentos fortificados.
9. HIERRO (III) PIROFOSFATO
Identificación y pureza según lo establecido en FCC, USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en suplementos dietarios y alimentos fortificados.
10. HIERRO (II) LACTATO
Identificación y pureza según lo establecido en FCC, USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en suplementos dietarios y alimentos fortificados.
11. HIERRO (II) SULFATO
Identificación y pureza según lo establecido en FCC, USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en suplementos dietarios y alimentos fortificados.
12. TAURINA
Identificación y pureza según lo establecido en FCC, FA Y USP y otras Farmacopeas.
Uso: como ingrediente para utilizar en elaboración de bebidas analcohólicas con cafeína y taurina, y en la elaboración de fórmulas infantiles.
13. COLAGENO
Se entiende por colágeno, el subproducto concentrado y seco obtenido a partir de las siguientes materias primas: cartílagos, tendones, huesos, trozos de cuero, fascias, aponeurosis y productos de la pesca.
El producto se denominará si la materia prima no fue sometida a ningún proceso de hidrólisis
Deberán cumplir con los siguientes requisitos:
a) No contener más de 2% de cenizas
b) No contener menos de 15% de nitrógeno
c) Salmonella: ausencia en 25 gramos Límites de residuos
Los límites de residuos permitidos quedan establecidos por el siguiente cuadro:
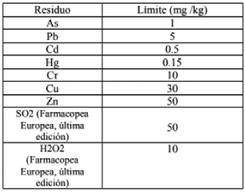
En la elaboración solo se permite el empleo de materia prima procedente de animales que no hayan sufrido ninguna restricción por parte de la Inspección Veterinaria. Se deberá declarar la especie animal de origen de la materia prima utilizada.
Para la elaboración de los productos queda prohibida la utilización de cueros y pieles que hayan sido sometidos a procesos de curtido, independientemente de si se completó dicho proceso. A efectos de su definición, se entiende por curtido el endurecimiento de pieles mediante agentes endurecedores vegetales, sales de cromo u otras sustancias como sales de aluminio, sales férricas, sales silíceas, aldehídos y quinonas u otros agentes endurecedores sintéticos.”.
ARTÍCULO 3º.- La presente Resolución entrará en vigencia a partir del día siguiente al de su publicación en el Boletín Oficial.
ARTÍCULO 4º.- Regístrese, comuníquese a quienes corresponda. Dése a la DIRECCIÓN NACIONAL DEL REGISTRO OFICIAL para su publicación. Cumplido, archívese. Josefa Rodriguez Rodriguez - William Andrew Murchison
e. 30/05/2019 N° 37827/19 v. 30/05/2019
Fecha de publicación 30/05/2019





